다비가트란은 부정맥 질환의 하나인 심방세동 환자에서 혈전생성에 의한 뇌졸중 발생의 위험을 예방하기 위한 치료제입니다. 다비가트란은 정형외과적 수술인 고관절 치환수술 또는 슬관절 치환수술을 받은 환자에서 혈전발생에 의한 심재성 정맥혈전증과 이로 인한 폐색전증의 치료 및 재발의 예방에도 사용됩니다.
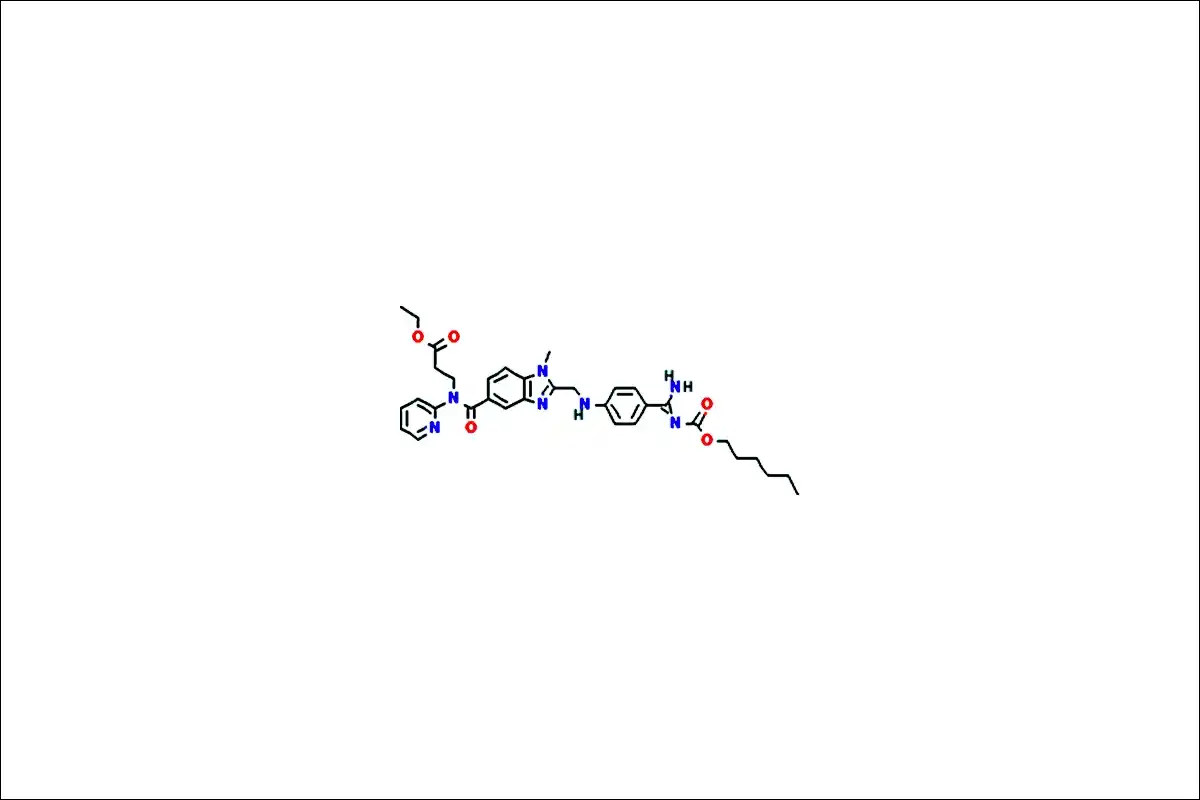
다비가트란의 구조식
| 외국어 표기 | dabigatran etexilate(영어) |
| CAS 등록번호 | 211915-06-9 |
| ATC 코드 | B01AE07 |
| 분자식 | C34H41N7O5 |
| 분자량 | 627.7g/mol |
목차
1. 심방세동
심방세동은 심방이 규칙적으로 뛰지 않고 분당 300~600회의 매우 빠른 파형을 형성하여 불규칙한 맥박을 일으키는 부정맥 질환의 일종입니다. 원인 질환으로는 기질적 심장 질환(심장판막증, 협심증, 심근증, 선천성 심질환 등), 고혈압, 갑상선 질환, 만성 폐질환, 체내 전해질 이상 등이 있으며, 30% 내외에서는 원인 질환 없이 발생하기도 합니다.
심방세동의 증상은 심방세동의 발생 양상, 심실 박동수, 동반된 질환, 심실 기능 및 합병증(혈전 색전증 등)에 따라 무증상부터 두근거림, 흉통(압박감), 호흡 곤란, 어지러움 또는 실신, 뇌졸중에 이르기까지 다양합니다.
심방세동의 치료는 원인이 되는 질환의 치료, 불규칙한 심박동 수를 조절하는 약물의 복용, 전기적 자극으로 심장의 리듬을 회복하게 하는 전기심장율동 전환술 등을 시행할 수 있습니다. 심방세동이 있는 사람들은 뇌졸중, 폐색전증 그리고 다른 합병증을 일으킬 수 있는 혈액 응고를 예방하기 위한 항응고제를 처방받게 됩니다.
항응고 약물로 와파린이 오랫동안 사용되어 왔으며, 회근에는 와파린보다 효과가 우수하며 부작용이 적고 복용하기 편리한(와파린과 같이 혈액검사가 필요 없고, 음식을 가릴 필요가 없는) 새로운 항응고제 (NOAC, New Oral Anticoagulant계열)가 많이 사용되고 있습니다.
2. 다비가트란 약리작용
다비가트란은 혈액 응고 과정이 진행되는데 필요한 효소단백질인 트롬빈(thrombin)에 직접적으로 작용하여 그 기능을 저해함으로써 유해한 혈전이 생성되는 것을 예방적으로 저해할 수 있습니다.
3. 다비가트란 효능∙효과
다비가트란은 비판막성 심방세동 환자에서 뇌졸중 및 전신색전증의 위험을 감소시킵니다. 또한 심재성 정맥혈전증 및 폐색전증의 치료와 재발 위험 감소의 효과도 있으며, 고관절 또는 슬관절 치환술을 받은 환자에게 정맥혈전색전증의 예방을 위해 쓰입니다. 제품으로는 프라닥사® 등이 있습니다.
4. 다비가트란 용법
다비가트란은 식사와 관계없이 물과 함께 복용하며 일반적으로 1일 2회 복용합니다.
치료질환과 목적에 따른 복용방법과 용량에 대한 상세내용은 제품설명서 또는 제품별 허가정보에서 확인할 수 있습니다
5. 다비가트란 금기사항
1) 치명적인 출혈
다비가트란은 때때로 치명적인 출혈을 유발할 수 있습니다. 다른 항응고제와 마찬가지로 출혈위험이 증가된 상태에서는 주의하여 사용합니다. 다비가트란으로 치료하는 동안 출혈은 어느 부위에서든 발생할 수 있습니다. 원인을 알 수 없는 헤모글로빈 및 헤마토크릿의 감소, 또는 혈압의 하강 시에는 출혈 부위에 대한 조사가 필요합니다.
2) 급성 신부전
급성 신부전이 발생한 환자는 다비가트란 복용을 중단해야 합니다.
3) 복용하면 안 되는 환자
중증 신장애 환자, 임상적으로 유의한 출혈이 있거나 출혈 위험성이 증가된 환자, 다른 항응고제와의 함께 복용치료를 받는 환자, 간장애 환자 또는 생존에 영향을 미칠 것으로 예상되는 간질환 환자, 강력한 P-glycoprotein* 저해제 함께 복용 환자, P-glycoprotein 유도제 함께 복용 환자, 항응고제 복용이 필요한 인공 심장판막 치환술을 받은 환자는 복용하지 않습니다.
*P-glycoprotein : 물질을 세포 밖으로 내보내는 역할을 주로 하는 당단백질의 하나로, 이 작용이 억제되면 복용한 약물의 체 내 잔존시간이 길어지면서 약물의 독성이 발생할 수 있습니다.
6. 다비가트란 부작용
다비가트란 복용 시 발생 가능한 주요 부작용은 다음과 같습니다.
1) 흔한 부작용(사용자의 10% 이상에서 보고)
출혈 및 출혈 관련 이상반응(빈혈, 트롬보사이트 감소증)
2) 일반적 부작용(사용자의 1~10%에서 보고)
위장관계 이상(소화불량, 위식도역류증, 위장관 출혈, 위장염)
3) 드문 부작용(사용자의 1% 미만에서 보고) 또는 빈도를 알 수 없는 부작용
발진, 간 기능 이상/간 기능 검사 이상, 호흡곤란, 현기증, 말초부종, 피로, 설사, 흉통 등
부작용이 발생하면 의사 또는 약사 등 전문가에게 알려 적절한 조치를 취할 수 있도록 합니다. 그 외 상세한 부작용 정보는 제품설명서 또는 제품별 허가정보에서 확인할 수 있습니다.
7. 다비가트란 상호작용
다비가트란과 함께 복용 시 상호작용을 일으킬 수 있는 약물은 다음과 같습니다.
1) 다비가트란의 부작용을 증가시킬 위험이 있는 약물(출혈 위험 증가)
항응고제(헤파린, 폰다파리눅스, 데시루딘 등), 혈소판응집제제(티클로피딘, 프라수그렐, 티카그렐러, 덱스트란, 설핀피라존 등), 아스피린과 비스테로이드성소염진통제(이부프로펜, 나프록센, 셀레콕시브 등), P-gp* 저해제(아미오다론, 베라파밀, 퀴니딘, 전신성 케토코나졸, 드로네다론, 티카그렐러 및 클래리트로마이신)
2) 다비가트란의 효과를 저하시킬 위험이 있는 약물
P-gp 유도제(리팜피신, 세인트 존스 워트, 카르바마제핀 또는 페니토인)
*P-gp : P-protein의 약자로 세포막에 존재하는 당단백질의 형태 중 하나입니다. 이물질을 세포 밖으로 내보내는 역할을 주로 하기 때문에 작용이 억제되면 약물의 체 내 잔존시간이 길어지면서 약물의 독성이 발생할 수 있습니다.
8. 다비가트란 주의사항
1) 사용상 주의사항
① 수술 후 완전히 지혈된 후에 다비가트란 치료를 재개합니다.
② 출혈 위험을 유의하게 증가시키는 손상, 상태, 절차 또는 약리학적 치료를 동반하는 경우, 면밀한 유익성-위해성 평가가 요구되며, 다비가트란은 유익성이 출혈 위험보다 큰 경우에만 사용해야 합니다.
③ 다비가트란은 일반적으로 일상적인 항응고제 모니터링을 필요로 하지 않지만, 추가적인 위험 요인이 있을 경우에는 항응고 효과를 측정하는 것이 도움이 될 수 있습니다. 그러나 다비가트란을 복용 중인 환자에게 INR 검사*는 수행하지 않습니다.
④ 소변 배출량 증가로 인한 체액량 손실 및 혈압강하 가능성이 있으므로, 저혈압 위험이 있는 환자는 복용 시 주의해야 합니다. 위장질환 등으로 인해 체액량이 감소된 환자에서는 상태가 회복될 때까지 일시적인 복용 중단을 고려해야 합니다.
⑤ 중증 신장애 환자는 다비가트란을 복용하지 않도록 복용 전에 미리 신기능 검사가 필요합니다. 또한 복용 중에는 1년에 1회 이상 신기능 검사가 필요하며, 신기능이 감소하거나 악화될 것으로 의심되는 특정 임상 상황에서는 보다 자주 신기능 검사를 할 필요가 있습니다.
⑥ 척추 마취, 경막외 마취, 척추 검사 등의 절차 시 완벽한 지혈기능을 갖추어야 합니다. 또한 카테터 제거 후 최소 2시간이 경과한 후에 다비가트란을 복용해야 합니다.
*INR 검사 : 혈액의 묽기를 검사하는 ‘프로트롬빈시간’ 이라는 검사가 있습니다. 혈액 검체 안에서 혈전이 생성되는 시간을 측정하는 검사인데, 이를 표준화하는 방식을 국제정상화비율 INR(International Normalized Ratio)이라고 하며, 이렇게 표준화한 검사 수치를 INR이라고 일반적으로 칭합니다.
9. 임산부∙수유부 사용
1) 임산부
동물실험에서 독성이 관찰되었으며, 사람에 대한 위험은 알려지지 않았으나 유소아로의 위험성을 배제할 수 없으므로 반드시 필요한 경우를 제외하고는 임산부는 복용하지 않습니다.
2) 수유부
다비가트란 복용 중에는 모유 수유를 중단합니다.
10. 소아·청소년 사용
18세 미만의 소아 및 청소년에 대한 안전성 및 유효성이 확립되어 있지 않으므로 복용하지 않습니다.
11. 고령자 사용
75세 이상 고령자의 경우 1회 110 mg, 1일 2회 복용을 고려할 수 있습니다.
12. 보관법
열과 습기, 직사광선을 피한 곳, 실온, 기밀용기에 보관합니다.
본문에서 언급되지 않은 그 외 상세한 정보는 제품설명서 또는 제품별 허가정보에서 확인할 수 있습니다.





